Chłoniaki z obwodowych komórek T (PTCL – peripheral T-cell lymphoma) to odmiana chłoniaków nieziarniczych. Można wyróżnić kilka podtypów tych chłoniaków.
W zależności od rodzaju komórek T rozróżnia się:
- Chłoniak z obwodowych komórek T bliżej nieokreślony
- Chłoniak anaplastyczny wielkokomórkowy
- Chłoniak angioimmunoblastyczny z komórek T
- Chłoniak enteropatyczny T – komórkowy
- Inne rzadkie typy chłoniaka z komórek T.
Węzłowe chłoniaki z obwodowych limfocytów (PTCL) są zaliczane do agresywnych postaci chłoniaków. Zazwyczaj diagnozowane są w zaawansowanym stadium i pojawiają się u osób powyżej 60 roku życia. Komórki tego chłoniaka są różnej wielkości. Obwodowy chłoniak T-komórkowy charakteryzuje się szybkim wzrostem, jak również tendencją do ekspansywnego wzrostu w krytycznych miejscach. Główną i zarazem istotną rolę w powstawaniu chłoniaków nieziarniczych odgrywają czynniki środowiskowe oraz związki chemiczne, jak na przykład pochodne węglowodorów aromatycznych, rozpuszczalniki.
Amerykańska Agencja ds. Żywności i Leków (FDA) zatwierdziła do leczenia tego typu chłoniaków Adcetris (brentuximab vedotin). Lek ten został już dopuszczony do obrotu przez organy rejestracyjne w ponad 45 krajach. Jest on koniugatem, czyli połączeniem przeciwciała monoklonalnego skierowanego przeciwko antygenowi CD30, który występuje w komórkach nowotworowych oraz leku pełniącego funkcję nośnika tego przeciwciała. Brentuximab vedotin umożliwia wybiórcze dostarczenie leku do komórki nowotworowej, doprowadzając jednocześnie do jej zniszczenia. Działanie leku Adcetris ukierunkowane jest wyłącznie na komórki nowotworowe i nie ma wpływu na zdrowe tkanki. Oznacza to, że lek dobrze tolerowany jest przez chorych, ponieważ charakteryzuje go niewielka toksyczność.
Dołącz do nas!
Tu znajdziesz przygotowane specjalnie dla Ciebie darmowe wsparcie w zmaganiach z rakiem!
Badanie przeprowadzone zostało u 452 pacjentów z pewnymi rodzajami chłoniaków PTCL, którzy otrzymali Adcetris oraz chemioterapię lub standardową chemioterapię (CHOP) jako leczenie pierwszego rzutu. Przeżycie wolne od progresji (ilość czasu, przez jaki pacjent pozostaje przy życiu bez wzrostu nowotworu) było znacznie dłuższe (współczynnik ryzyka 0,71, wartość P 0,01) podczas podawania leku Adcetris (mediana 48 miesięcy, w porównaniu z 21 miesiącem z CHOP). Całkowite przeżycie i ogólne wskaźniki odpowiedzi były również znacznie lepsze podczas stosowania Adcetrisu.
Do najczęstszych działań niepożądanych podczas stosowania preparatu Adcetris w połączeniu z chemioterapią należą:
- Nudności
- Wymioty
- Biegunka
- Zmniejszenie liczby białych krwinek
- Zmęczenie
- Owrzodzenie jamy ustnej
- Zaparcia
- Wypadanie włosów/ utrata włosów
- Gorączka
- Mała liczba krwinek czerwonych (niedokrwistość).
Poniżej przedstawiono działania niepożądane produktu leczniczego Adcetris według klasyfikacji układów i narządów:
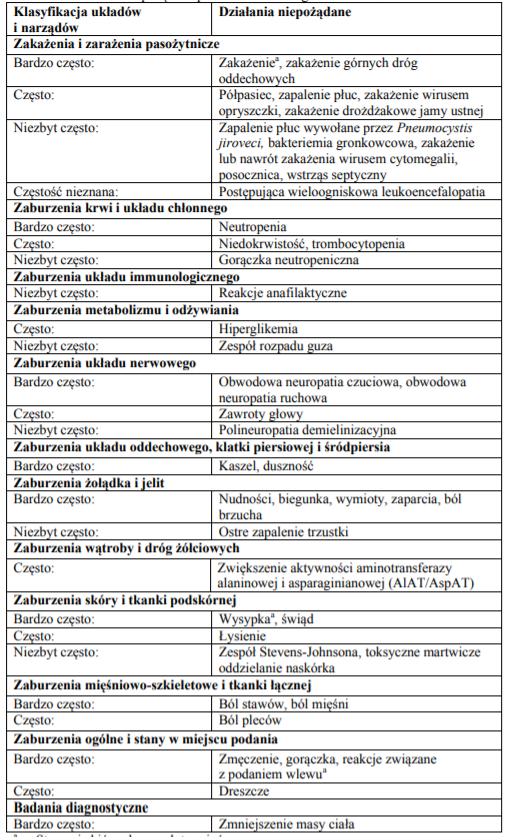
Źródło: www.ema.europa.eu/documents/product-information/adcetris-epar-product-information_pl.pdf
Pracownicy służby zdrowia powinni monitorować pacjentów pod kątem reakcji na infuzję, zagrażających życiu reakcji alergicznych (anafilaksja), neuropatii, gorączki, powikłań żołądkowo-jelitowych i zakażeń. Pacjenci powinni również być monitorowani pod kątem zespołu lizy guza (powikłanie wynikające ze śmierci wielu komórek nowotworowych w tym samym czasie), ciężkich reakcji skórnych, działań niepożądanych w płucach (toksyczność płucna) i uszkodzenia wątroby (hepatotoksyczność).
Należy zwrócić uwagę na to, iż kobiety w ciąży oraz karmiące piersią nie powinny przyjmować leku Adcetris, ponieważ może to zaszkodzić rozwijającemu się płodowi, jak również nowonarodzonemu dziecku, które spożywa pokarm matki.
Seattle Genetics (firma biotechnologiczna) uzyskała pozwolenie od Agencji ds. Żywności i Leków (FDA) na korzystanie z leku Adcetris.
FDA (Agencja ds. Żywności i Leków) to amerykańska instytucja rządowa, która chroni zdrowie publiczne zapewniając bezpieczeństwo i skuteczność leków i szczepionek dla ludzi i zwierząt, oraz innych produktów biologicznych stosowanych u ludzi, a także urządzeń medycznych. Agencja jest również odpowiedzialna za bezpieczeństwo żywności, kosmetyków, suplementów diety, produktów emitujących promieniowanie elektroniczne oraz za regulację wyrobów tytoniowych.
Autor: Agata Ernst
- www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm626079.htm
- www.ema.europa.eu/documents/product-information/adcetris-epar-product-information_pl.pdf
- www.seattlegenetics.com/
- www.adcetris.com/
- Piekarz RL, Robey RW, Zhan Z et al.: T-cell lymphoma as a model for the use of histone deacetylase inhibitors in cancer therapy: impact of depsipeptide on molecular markers, therapeutic targets, and mechanisms of resistance. Blood 2011; 103: 4636-4643
- Sieniawski M, Angamuthu N, Boyd K et al.: Evaluation of enteropathy-associated T-cell lymphoma comparing standard therapies with a novel regimen including autologous stem cell transplantation. Blood 2010; 115: 3664-3670.
- Kordek, Onkologia, podręcznik dla studentów i lekarzy, Gdańsk 2013
- hematoonkologia.pl/edukacja/news/id/2069-refundacja-adcetrisu-dlugo-oczekiwana-zmiana-na-listach-refundacyjnych/















